人乳头瘤病毒全基因组分型参考品
用途:用于以非 L1 区域为靶序列的人乳头瘤病毒核酸(基因分型)检测试剂盒(包括以非L1 区域如 E6、E7、E1 区域和全基因组为靶序列)质量控制和评价。
人乳头瘤病毒全基因组分型参考品组成:20 种不同型别阳性参考品,阴性参考品N1-N5.阳性参考品型别如下:
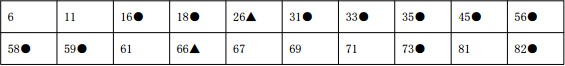
注:1.●代表高危型,共有 11 种。2.▲代表中等危险型,共有 2 种。
装量:阳性参考品分装:采用分光光度计测量 20 种不同 HPV 基因型的 HPV 全基因组重组质粒浓度,用 1ng/μL 人基因组 TE 溶液,将每个型别的 HPV 重组质粒稀释到 106copies/ml 左右。在通风橱中分装到 1.5ml 冻存管中,每管 100μL,每套 20 支,各种型别的 HPV 基因型质粒各 1管。
阴性参考品分装:阴性参考品 N1-N5 每管 100μL,在通风橱中分装到 1.5ml 冻存管中。分装好的参考品放入-20℃冰箱中进行保存
质量标准:
1、准确性(阳性符合率):要求检测试剂盒检测范围内人乳头瘤病毒不同型别国家分型参考品结果应均为阳性。
2、特异性:a) 检测 5 份阴性参考品,检测结果应为阴性。
b) 检测试剂盒检测本参考品 20 种不同型别阳性参考品,检测结果应为:
1)PCR-荧光法检测试剂盒,不在其检测范围内的高危型别,应不得出现交叉;不在其检测范围内的低危型别,交叉反应率应分别不大于 15.0%;
2)PCR-杂交法等 PCR 杂交原理的检测试剂盒,不在其检测范围内的高危型别,应不得出现交叉;不在其检测范围内的低危型别,交叉反应率应分别不大于 10.0%;
3)杂交捕获-化学发光原理的检测试剂盒,应注明其交叉型别。
3、重复性(精密度):要求检测试剂盒检测范围人乳头瘤病毒多个型别国家分型参考品反应结果应一致、且均为阳性。
4、检测限:要求检测限应不高于 104copies/反应。
注意事项:
1.PCR 操作按照分区进行,使用带滤芯的枪头吸取,防止污染。稀释时应避免剧烈震荡。2. 应于-20℃以下储存,避免反复冻融。


